Int J Mol Sci|深圳先进院屠洁研究员团队发现“化悲痛为食欲”的神经细胞机制
长期的压力应激会使人过度消费美味可口的食物,如糖类食品或饮料,以减轻压力造成的心理和生理的影响,但高糖摄入会给人们带来包括肥胖在内的代谢性疾病等消极后果。然而,因长期高糖摄入引起的压力下的暴饮暴食的神经基础并不完全明确,所以相应的调节手段也极为有限。

文章上线截图,点击文末“原文链接”查看全文
2022年12月30日,中国科学院深圳先进技术研究院(简称“深圳先进院”)脑认知与脑疾病研究所、深港脑科学创新研究院屠洁研究员课题组在国际期刊International Journal of Molecular Science上在线发表题为“Sugar beverage habitation relieves chronic stress-induced anxiety-like behavior but elicits compulsive eating phenotype via vLSGAD2 neurons”的研究论文,借助转基因动物和化学遗传学等技术,揭示了小鼠在焦虑时食欲上涨并出现暴饮暴食现象的神经生物学机制。
本文研究了上述问题背后的神经机制,研究人员使用双瓶蔗糖选择范式。让小鼠暴露在模拟日常生活压力的慢性不可预测的温和压力源(CUMS)中,在连续喝蔗糖的CUMS 21天后,使用高架迷宫和旷场测试来探索焦虑样行为。结果发现正常喝水的CUMS小鼠比喝蔗糖的CUMS小鼠表现出更高的焦虑水平。尽管喝蔗糖显示出抗焦虑的作用,喝蔗糖的小鼠却也表现出暴饮暴食和强迫性饮食的负性表型。该研究进一步发现,在强迫性进食后,蔗糖处理的CUMS小鼠大脑外侧隔核腹侧部(vLS)的c-Fos表达明显增加。对vLSGAD2神经元的化学遗传激活可以维持普通饲料的摄入,但当小鼠进食受到厌恶性闪光刺激时,在未接受应激的GAD2-Cre小鼠中诱发了强迫性进食的表型,模拟了慢性应激期间过度饮用蔗糖的负面后果。此外,vLSGAD2神经元的化学遗传学激活进一步加剧了应激后GAD2-Cre小鼠的焦虑水平,但没有改变未受应激小鼠的基础焦虑水平。此现象可部分解释成瘾患者高并发焦虑障碍的神经细胞机制。
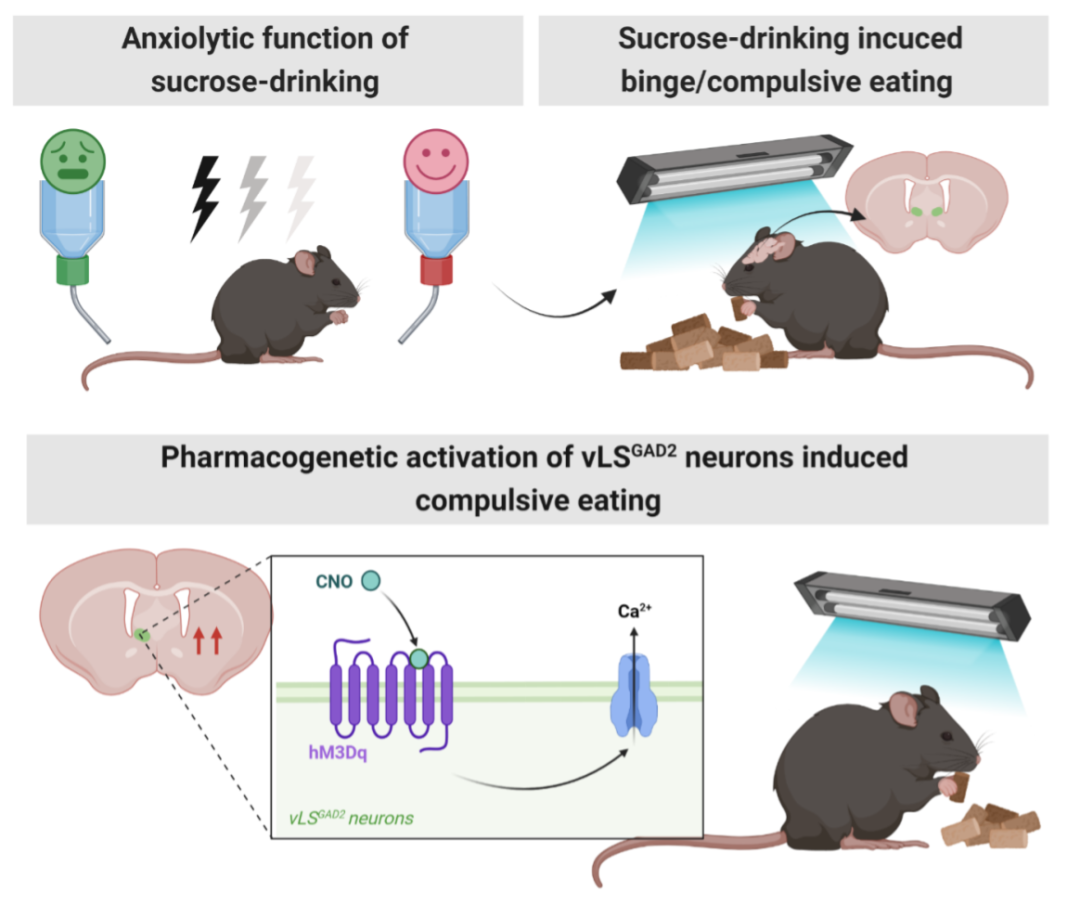
糖水减轻小鼠焦虑但引起暴食表型伴vLSGAD2神经元异常
综上,本研究揭示了,vLS内的GABA能神经元可能是压力导致焦虑障碍合并饮食障碍的一个潜在干预靶点,为研究焦虑与进食行为之间的关系及其神经机制提供了科学数据。深圳先进院屠洁研究员为该论文的通讯作者,深圳先进院助理研究员刘丹、西安交通大学客座硕士生胡豪豪为共同第一作者,深圳先进院为第一和通讯单位。
屠洁研究员团队近年关注慢性压力应激引发的焦虑行为的神经环路机制(Molecular Psychiatry,2020),精神疾病动物模型风险决策能力异常的细胞机制(Neuroscience Bulletin,2021)及其慢性压力应激促进外周乳腺肿瘤的快速生长的环路机制等(CNS Neuroscience and Therapeutics,2021)。
该研究得到了国家自然科学基金委项目、广东省重点领域研发计划项目、深圳市自然科学基金基础研究重点和面上项目及深圳市神经系统疾病神经免疫调控重点实验室的资助。